Derivados Nitrogenados de los Hidrocarburos
- El nitrógeno tiene la capacidad de formar enlaces sencillos, dobles y triples con los átomos de carbono, lo que determina que sean varios los grupos funcionales nitrogenados posibles.
- Los derivados nitrogenados de los hidrocarburos son añinas, amidas, nítralos y nitrocompuestos.
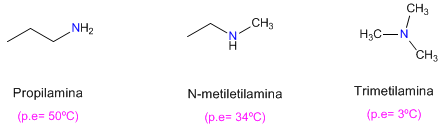
- Son compuestos derivados del amoníaco al sustituir uno, dos o tres de sus hidrógenos por radicales alquílicos o aromáticos. Según el número de hidrógenos que se sustituyan se denominan aminas primaria, secundarias o terciarias.
- El átomo de N posee un par de e- libre, de manera que la forma de la molécula es tetraédrica.
- El par de electrones solitario en el nitrógeno los hace básicos y nucleofilicos.
- Muchas aminas son "bioactivas" produciendo diversas respuestas biológicas desde alteración del estado de animo, alucinaciones o muerte.
- Ocurren en plantas y animales
- Trimetilamina-animales; olor de peces
- Nicotina - tabaco
- Cocaína - estimulante; arbusto de coca
- Se nombran añadiendo al nombre del radical hidrocarbonado el sufijo "-amina".
|
- En las aminas secundarias y terciarias, si un radical se repite se utilizan los prefijos "di-" o "tri-", aunque, frecuentemente, y para evitar confusiones, se escoge el radical mayor y los demás se nombran anteponiendo una N para indicar que están unidos al átomo de nitrógeno.
|
- Cuando las aminas primarias no forman parte de la cadena principal se nombran como sustituyentes de la cadena carbonada con su correspondiente número localizador y el prefijo "amino-".
|
- Cuando varios N formen parte de la cadena principal se nombran con el vocablo aza.
|
- Los N que no formen parte de la cadena principal se nombran como amino-, aminometil-, metilamino-, etc.
Propiedades químicas (basicidad)
Las propiedades químicas de las aminas son semejantes a las del amoniaco. Al igual que éste, son sustancias básicas; son aceptores de protones, según la definición de Brønsted-Lowry.
Las aminas presentan reacciones de neutralización con los ácidos y forman sales de alquilamonio (también denominadas sales de amina). Por ejemplo la etilamina se combina con el ácido clorhídrico, para producir cloruro de etilamonio.
El cloruro de etilamonio es una sal de alquilamonio. Un grupo etilo y tres átomos de hidrógeno están unidos al átomo de nitrógeno en este compuesto. Si la dietilamina, (CH3CH2)2NH, se combina con el HBr se produce el brumuro de dietilamonio, una sal de dialquilamonio.
Un uso práctico para convertir las aminas a sus sales es el producir aminas de mayor masa molecular y solubles en agua. La mayoría de las aminas de gran masa molecular son insolubles en agua, pero después de combinarse con un ácido forman una sal de amina iónica soluble. Por ejemplo, la lidocaína, un anestésico local que es insoluble en agua como amina libre; después de combinarse con el HCl forma un clorhidrato de lidocaína el cual es soluble en agua.
La lidocaína es insoluble debido al carácter no polar de la molécula. Después de combinarse con el HCl se convierte en un compuesto iónico. Un gran porcentaje de los compuestos iónicos son solubles en agua.
Muchas de las aminas esenciales en los seres vivos existen como sales de aminas y no como aminas. Uno de estos compuestos es el neurotransmisor acetilcolina. La acetilcolina se libera en el extremo de un nervio, viaja a través de la brecha sináptica, se une a otro miembro y origina un impulso nervioso. Durante el tiempo en que la molécula de acetilcolina viaja a través de la brecha sináptica, su estructura es la siguiente:
Basicidad de las Aminas
• Son bases fuertes. Pueden sustraer un protón del agua, formando un ión amonio y un ión hidroxilo. A la constante de equilibrio de esta reacción se le llama constante de basicidad de la amina y se representa por Kb.
Basicidad de las Aminas
Las alquilaminas son bases más fuertes que el amoniaco. Esta diferencia se explica por el efecto electrón-dador de los grupos alquilo, que estabilizan la carga positiva del nitrógeno, lo que provoca una disminución de la energía potencial del catión correspondiente y desplaza el equilibrio hacia la derecha.
- De acuerdo al anterior razonamiento, se debería esperar que las aminas secundarias fuesen bases más fuertes que las aminas primarias, y las aminas terciarias fuesen bases más fuertes que las aminas secundarias. La situación real es más complicada debido a la solvatación.
Amidas:
¿QUE SON?
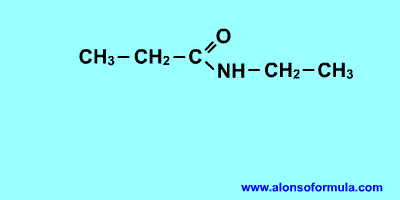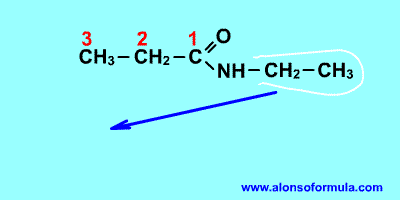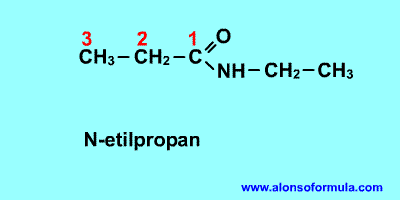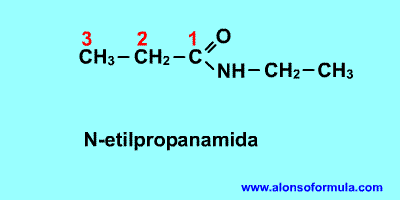
Es un compuesto orgánico que consiste en una amina unida a un ácido carboxílico convirtiéndose en una amina ácida (o amida). Por esto su grupo funcional es del tipo RCONH'', siendo CO un carbonilo, N un átomo de nitrógeno, y R, R' y R'' radicales orgánicos o átomos de hidrógeno:
FORMULA GENERAL
 |
| tridimencional |
REACCIONES DE AMIDAS
- Hidrólisis ácida o básica: La amida se hidroliza en medio básico formando un carboxilato de metal o en medio ácido formando un ácido carboxílico.
- Deshidratación: En presencia de un deshidratante como cloruro de tionilo o pentóxido de fósforo se produce un nitrilo.
- Reducción: Las amidas pueden reducirse con hidruro de litio y aluminio a aminas.
- Transposición de Hofmann: En presencia de un halógeno en medio básico se produce una compleja reacción que permite la obtención de una amina con un carbono menos en su cadena principal.
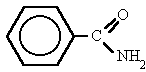
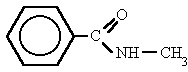
¿DONDE SE ENCUENTRAN?
Nomenclatura:
Derivan de los ácidos carboxílicos por substitución del grupo -OH por un grupo
dando lugar a amidas sencillas, amidas N-sustituidas o N, N-disustituidas.
| ||||||||||||
Se nombran como el ácido del que provienen, pero con la terminación "-amida".
| ||||||||||||
| ||||||||||||
| ||||||||||||
|
Fuera de la bioquímica y la medicina, los nitritos se usan como bactericidas, siendo su agregación a las carnes de uso bastante común. Esto con el propósito de curarlas y prolongar por más tiempo su calidad y frescura.
El nitrito tiene dos rostros: uno beneficioso para la salud, y otro que la pone en peligro. El rostro bueno se debe precisamente a las reacciones que lo reducen a NO. Mientras, el rostro malo se debe a su transformación a nitrosamina: una familia de compuestos orgánicos que tiene varios miembros a los que se les ha reconocido como sustancias cancerígenas.
Propiedades de los nitritos
Basicidad
Los nitritos son sales básicas, pues el anión NO2– es la base conjugada del ácido nitroso, HNO2:
HNO2 + H2O ⇌ NO2– + H3O+
En agua y en pocas cantidades se hidroliza para originar iones OH–:
NO2– + H2O ⇌ HNO2 + OH–
Esta basicidad es intrínseca para todas las sales de nitrito, ya que depende del NO2– y no de los cationes que lo acompañan. Sin embargo, estos cationes y sus interacciones con el NO2– sí afectan las solubilidades de las sales de nitrito en el agua y otros solventes polares.
Reacciones
Las reacciones de los nitritos varían dependiendo de qué cationes acompañan al NO2–, o de si se trata de un nitrito orgánico, RONO. En términos generales, los nitritos pueden descomponerse, oxidarse o reducirse a: óxidos metálicos, NO3–, NO2, NO, e inclusive gas nitrógeno, N2.
Por ejemplo, el nitrito de amonio, NH4NO2 puede descomponerse a N2 y H2O.
Apariencias físicas
Casi todos los nitritos son sólidos de apariencia cristalina. Muchos son de colores blanquecinos o amarillentos, aunque los hay coloridos si contienen cationes de metales de transición.
Por otro lado, los nitritos orgánicos en su mayoría son líquidos volátiles altamente inestables y explosivos.
Estructura
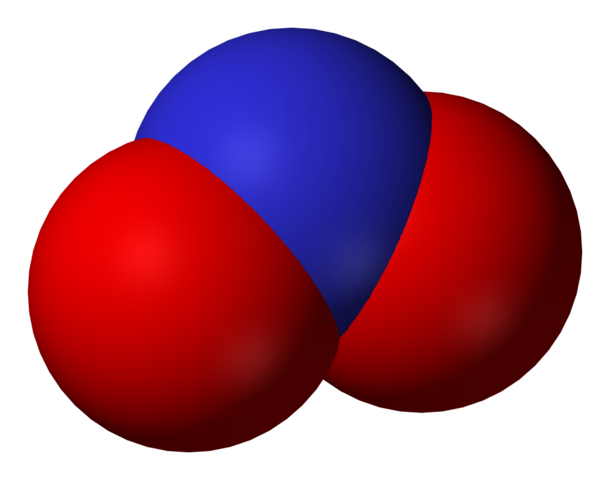
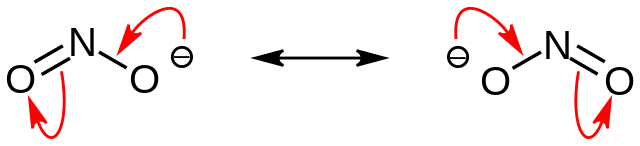
Anión nitrito
En la primera imagen se mostró el anión nitrito con un modelo de espacio lleno. Este modelo tiene la desventaja que es exactamente el mismo que el del dióxido de nitrógeno, NO2. En cambio, la imagen superior describe mejor el anión nitrito y cómo se comporta su carga negativa.
Los nitritos tienen efectos antibacterianos, por lo que se agregan en moderadas cantidades a la carne para ralentizar su putrefacción. Además de cumplir esta función, reaccionan con las proteínas de la carne para otorgarles una coloración más rojiza y atractiva.
El lado malo de esta práctica es que algunas carnes pueden tener demasiadas sales de nitrito, y al cocinarlas a altas temperaturas, se transforman en nitrosoaminas. Por lo tanto, existe el riesgo de aumentar las probabilidades de contraer algún tipo de cáncer si el consumo de estas carnes curadas es excesivo.
Tintes azo
Los nitritos se utilizan en química orgánica para llevar a cabo la reacción de diazotación, con la cual se sintetizan los colorantes o tintes azo.
Pigmentos
Algunos complejos de nitrito, como los de cobalto, pueden utilizarse como pigmentos para las pinturas o porcelanas debido a sus llamativas coloraciones.
Vasodilatador
Los nitritos son responsables de generar óxido nítrico en el organismo en regiones deficientes de oxígeno. El NO es una molécula de señalización, a la que responde los vasos sanguíneos relajándose y expandiéndose. Esta expansión o dilatación tiene como consecuencia que disminuya la presión arterial.
Ejemplos de nitritos
Para finalizar, se enlistarán algunos ejemplos de nitritos con sus respectivas fórmulas y nombres:
-NaNO2: nitrito de sodio
-KNO2: nitrito de potasio
-Mg(NO2)2: nitrito de magnesio
-Ca(NO2)2: nitrito de calcio
-CH3CH2ONO: nitrito de etilo
-NH4NO2: nitrito de amonio
-Zn(NO2)2: nitrito de zinc
-Pb(NO2)2: nitrito de plomo (II) o nitrito plumboso
-Fe(NO2)3: nitrito de hierro (III) o nitrito férrico
-(CH3)2CHCH2CH2ONO: nitrito de isoamilo


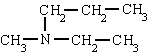
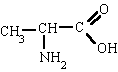





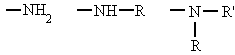
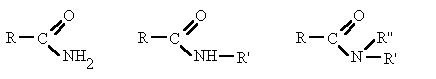
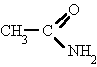
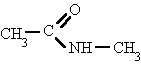
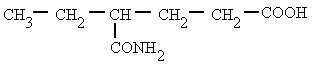
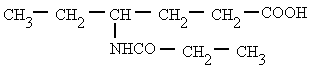

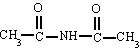
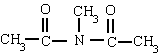
No hay comentarios:
Publicar un comentario